性腺发育异常( disorders of sex development,DSD) 或性分化异常( disorders of sex deferentiation,DSD) 的诊断治疗一直都是儿科乃至成人内分泌领域争论多,且共识较少的一个分支,原因涉及到观念、宗教、文化、医疗技术和家长认知误区等外在问题,而最根本的原因是DSD 表观的变异,导致对症状评估把握不良,实验室评估手段匮乏导致诊断的不确定。若没有足够的临床实践和理论基础,不能掌握正常的变异和疾病的差别,也就不能准确处理DSD。
DSD 是一个笼统的分类,不是确切的疾病诊断,不同病因预后不同,而同一病因也可因表观的严重度不同而走向完全不同的结局。DSD 的不同病因可有相同或相似的临床表型,同一病因的DSD 因发生时间早晚或严重程度不同所致的临床表型差异亦甚大。许多DSD 患儿在儿童早期被误诊或漏诊,直接影响了治疗策略及其预后。
儿童处于生长发育阶段,DSD 发展究竟是走向正常还是趋向严重,有些是难以预料的。对于DSD 错误的处理,有时甚于不进行处理造成的危害。有些DSD 儿童成年后显现了对早期处理不良的遗憾,甚至导致对不当医学处理的抗议,尤其是不同程度地影响了生殖功能,并可能诱发与性发育、性心理和性行为等相关的问题,造成心理和行为偏差。因此,DSD 不仅是医学问题,还可能成为社会问题。也正是基于DSD 的复杂性,儿科内分泌医师均较保守地处理DSD 问题。
1 DSD 概述和分类
人类的性别分为社会性别和生物性别。社会性别是指在社会活动中显示的性别,包括家人、朋友、周围人群、社会机构和法律机关的认定,通俗地说即户口本上认定的性别。
生物性别是指男女性之间表现的性状差别,包括内在性状和外在性状两方面。内在性状特征先出现,外在性状特征在内在性状特征基础上衍生而来。人类生物性别可分为遗传性别、性腺性别和表型性别( 即物理查体呈现的表观) ,正常情况下,遗传性别控制着性腺性别分化,性腺性别又支配着表型性别分化。如果遗传性别、性腺性别和表型性别三者任一出现内在性状或外在性状异常,即称为性发育异常或性分化异常。
近年来国内有些儿科专家将DSD 翻译为“性发育障碍”。DSD 内在的含义是性发育存在异常或障碍。异常的概念外延比较大,包括了偏离正常的发育,也包含了正常方向的发育但有停滞; 障碍则更倾向于停滞。中文表述的不正常意味异常。因此,性发育异常或性分化异常更能涵盖这类复杂疾病的意义。由陈家伦主编的、上海科学技术出版社2012 年版的、成人的专著《临床内分泌学》也将DSD翻译为“性分化异常”。
初生至暮年,从性腺生殖发育的角度有如下几个阶段:下丘脑-垂体-性腺( HPG) 轴生后的快速反应期→静默前的小青春期→静默状态的儿童期→青春期→成熟期→更年期→停经期( 暮年期) 。唯有儿童期( 大约10 年) 由于HPG轴不活动不能评价HPG 轴的功能。
青春期和成熟期的界限是模糊的,青春期开始有明确定义,如以女孩乳房Tanner Ⅱ期,男童睾丸容积≥4 mL 为界。女孩月经初潮和男孩初次遗精是青春期后期标志,也仅表示接近成熟。成熟期是指月经初潮后至月经规律,女孩初潮后可以有2 年左右的无排卵期,也有些女孩初潮后不久就规律排卵了; 而男孩的成熟期界限更为模糊,男孩发现睾丸容积> 6 mL 就可以有初次遗精,睾丸容积> 10 mL者55.3%有初次遗精,睾丸容积> 16 mL 者84.7% 有初次遗精,遗精后逐渐成年成熟。
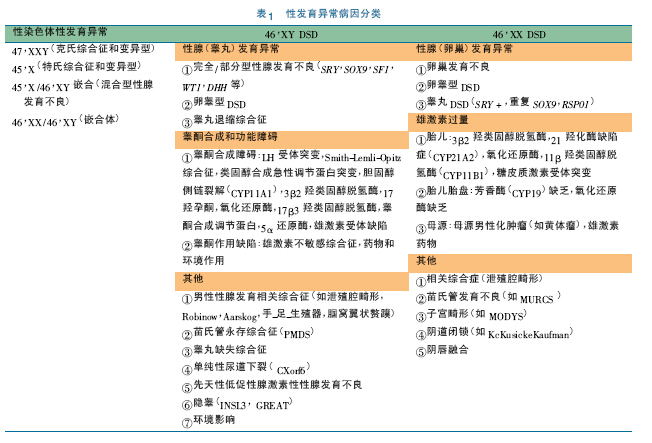
DSD 具有表现度的显著差异性及高度遗传异质性,是一系列难以归类、难以诊断的复杂性疾病。性发育异常分为三类: 性染色体DSD( 主要与性染色体核型异常有关) 、46,XY DSD( 主要与睾丸分化发育异常及雄激素合成、利用障碍有关) 和46,XX DSD( 主要与SRY 基因易位、雄激素过量有关) [1]。表1 显示了DSD 病因分类[2]。
医学上人为界定的、并已经达成共识的青春期发育节点: ①青春发育延迟的诊断是指男性14 岁,女性13 岁无青春期第二性征或中途发育停滞; ②性腺功能低下大多需要在18 岁后确诊; 儿童谈不到性功能的问题。青春期延迟需要鉴别: 体质性( 疾病、营养、过度疲劳等) 是暂时性的; 而器质性是指HPG 轴的病变,意味着成年期性功能和生殖能力的低下; 所以对青春期延迟的诊断要非常谨慎。准确地说0 ~ 18 岁儿童青少年期通常根据原发病预估成年后性腺功能低下的可能性,比如: 无睾症、原始性腺、条索状性腺和原发性或先天性性腺发育不良( 睾丸发育不良和原发卵巢发育不良) 等染色体异常的DSD 成年后常常发生性腺功能低下。成人的高促性腺激素性功能减低( 高促性腺激素性性腺发育不良) ,可在青春期年龄或更早被发现; 低促性腺激素性功能减低( 低促性腺激素性性腺发育不良) 绝大多数在18 岁以前是不能诊断的,仅某些特殊病例可以提早到儿童期诊断,比如Kallmann 综合征,由于肢体联动、嗅觉异常、家族史和嗅球的影像学异常甚至基因异常而诊断。
2 DSD 患儿评估
由于儿童的发育是一个连续的过程,疾病造成的性腺损害程度也是一个连续的谱系,从完全不发育到基本接近正常。在儿童期大多不能完全确定性腺功能损害或残留的程度。儿童期仅仅可预估成年时其性腺功能低下的可能性。对于预估可能的自然性发育障碍者,可以在围青春期的适当年龄给予诱导青春期的治疗。至于性功能和生育力的评估是根本无法在儿童青少年期进行的。
2.1 性发育疾病的诊断评估新生儿的外生殖器模糊均可诊断为DSD,但性别确认则需要一定的时间,尤其是不要早期武断地评判,避免与最终正确的诊断不符。DSD 患者的明确诊断、性别确认和治疗,需由多学科专家组成治疗小组共同完成,一般包括儿科内分泌、整形外科、泌尿外科和妇产科专家,以及遗传学家、精神心理学专家、社会工作者和医学伦理学工作者。多学科组成的专家小组是理想的情况,在有条件的地区方可能实现。
婴儿DSD 只有4% ~ 7% 在出生时生殖器模糊及性别不明,多数表面看来性别清楚。所以新生儿医生应该注意DSD 的发现。当双侧触不到睾丸、尿道下裂并单侧或双侧触不到睾丸、阴蒂肥大、阴茎缩短伴单一泌尿生殖道开口(也被称为泌尿生殖窦) 、表型为女孩的婴儿出现腹股沟疝且可及性腺需高度怀疑DSD。DSD 特征包括: ①明显的生殖器模糊( 如泄殖腔外翻) ; ②明显的女性外生殖器,但阴蒂肥大、阴唇融合,或腹股沟/阴唇包块; ③明显的男性外生殖器伴双侧隐睾,小阴茎,单纯性会阴型尿道下裂,或轻度尿道下裂伴隐睾; ④有DSD 家族史,如完全性雄性激素不敏感综合征( CAIS) ; ⑤生殖器表型与染色体核型不一致。
年龄较大的儿童考虑诊断DSD 的线索: 生殖器模糊,女性腹股沟疝,原发性闭经,表型男性患者出现乳房发育,表型为男性的患者出现周期性肉眼血尿。对具有以上临床表现的患者,需进一步进行性腺和外生殖器全面临床评估以助诊断,以及性别选择、手术干预和长期治疗策略的制定[3]。
家族史及母孕史的采集: 父母双方近亲的相关情况,有无失盐病史,无原因的婴儿死亡史,亲属的生殖器畸形史;家族中有无青春期发育延迟、嗅觉减退和不孕不育病史等。近亲结婚可增加患常染色体隐性遗传病的风险,如先天性肾上腺增生、睾酮合成障碍、Leydig 细胞发育不良和5α 还原酶缺乏等。早产儿有误诊DSD 的风险,因此早产儿应慎重。母亲孕期有无外源性雌激素、孕激素摄入史[4]。辅助生殖技术带来的人工妊娠已经构成一定妊娠的基数,目前尚无足够证据说明其与DSD 发病率之间的关系[5]。
2.2 体格检查
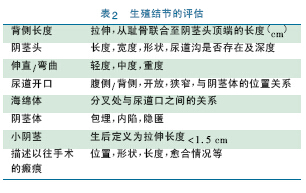
2.1.2.1 生殖结节( genital tubercle,GT or genital protuberance) 的评估GT 是胚胎结构,可发育为阴茎或阴蒂。在评定畸形( 如尿道下裂) 时对GT 的描述尤为重要,而评价结节的大小对鉴别小阴茎和隐匿阴茎也十分重要,隐匿阴茎GT 大小通常正常,只是由于皮肤皱褶的覆盖看起来偏小。对阴茎重度下弯的病例,是很难评估结节的真正长度的,只有在手术过程中下弯纠正后可以进行评估。
GT 评估内容见表2。
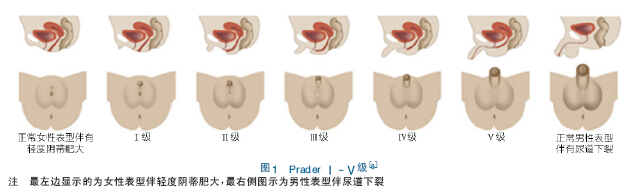
2.2.2 Prader 分级、外生殖器男性化评分( external masculinization score,EMS) EMS[6,7
]分级为比较GT 的解剖学提供客观标准,但均未被临床普遍接受。Prader 分级和EMS 的不足为外生殖器的男性化程度与阴道尿道融合的水平之间没有相关性。
图1 显示Prader 分级标准,根据外阴男性化程度及阴道与尿道汇合点的高度可分为Ⅰ ~ Ⅴ型,以评估外生殖器的解剖状况是接近正常男性还是正常女性。Isabelle 等[8]认为Prader 分级不完全准确。
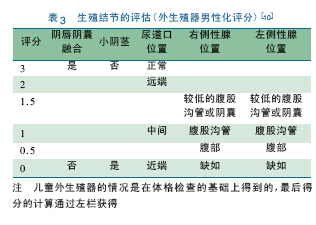
EMS 是另一个分级系统,可以提供一个更有识别力、更客观的外生殖器评估方法[10]。表3 显示,该系统通过对阴唇阴囊融合、小阴茎、尿道口位置、性腺的位置和是否存在等进行定量评价,以判断外生殖器的男性化水平,需要说明的是,中间型的评判依据临床经验。
2.2.3 尿道、生殖皱褶和会阴的评估评估需要系统地记录一系列观察结果: ①生殖皱褶融合情况( 描述程度: 完全开裂,部分融合,融合) ; ②生殖皱褶/着色/对称; ③发育不全/生殖皱褶缺失; ④生殖皱褶与生殖结节转位; ⑤尿道/会阴口( 数量/位置和之间的关系) ; ⑥青春期Tanner 分期; ⑦术后瘢痕。
最近测量肛门-生殖器距离( anus genitalia distance,AGD) 研究[11]受到重视。AGD 是从肛门中点至阴唇系带后侧或阴囊-会阴连接处之间的长度( cm) ,是一种非侵袭性的检查方法,操作简单方便、可靠,长度越长提示男性化程度越高,也提示出生前暴露于雄激素。对孕鼠给予不同剂量激素暴露,以AGD 作为观察新生鼠外生殖器的男性化的指标,毒理学研究显示,AGD 缩短是宫内抗雄激素物质作用后的敏感指标[12,13]。还有动物实验发现暴露于抗雄激素或雌激素类物质的孕鼠其雄性后代AGD 缩短,发生尿道下裂、隐睾比例显著增加[14 ~ 16]。
临床上,人类一般以阴茎的大小作为雄性化的衡量指标。随着对AGD 认识的深入,国外一些研究者开始尝试性将AGD 应用于临床,作为衡量雄性化的一个指标,以此来评估孕期宫内雌激素暴露水平[17,18]。有学者研究隐睾、尿道下裂与AGD 关系用于成年男性生殖力的评估。目前AGD 已被美国环保局列为人类生殖毒理学研究指南中重要的生物学标记。但是研究处于试验阶段,研究策略和方法还存在分歧,结果自然也存在争议。评价青少年患者青春期发育通常还是使用Tanner 分期系统进行分类[19,20]。
2.3 性腺评估必须记录可触及性腺是否存在,数目及位置。如果在阴唇阴囊褶( 生殖皱褶) 可以触及到性腺,提示睾丸组织是存在的。如果两侧均不能触及性腺,则需要进一步详细的评估。此项评估依赖于其他资料如染色体核型和性激素水平。超声检查和MRI 可用于鉴定腹股沟区或腹腔内是否存在性腺。在腹股沟区可触及性腺组织则可能是睾丸或卵睾,罕见卵巢。在腹股沟区可触及单侧卵巢的可能性很小[21]。另外,应注意检查患者是否存在其他中线结构异常,如唇裂或腭裂,可能提示存在垂体-下丘脑异常。
对于DSD 患者,阴茎的长度远没有性腺的诊断价值有意义。2006 年Lawson Wilkins 儿科内分泌学会( LWPES)和欧洲儿科内分泌学会联合制定的指南,汇总了不同研究所报道的外生殖器的测量值,此后国内外也有一些大样本的阴茎及睾丸大小测量的研究[22,23]发表,综合分析上述研究结果,随着时间的推移,阴茎长度的正常值有所增长。但不能排除不同人群和研究者测量方法的误差,同时也与青春期发育有关,可比性不强。不仅如此,实际阴茎的测量很难达到十分精确的程度,患儿的配合程度,操作者的手法及经验都会对测量值有影响,尤其误差不足0.5 cm 以内的操作测量误差值在允许范围。以上这些必然造成阴茎测量正常值的差异。另外青少年身高及性发育有提前的趋势造成基于年龄的阴茎长度也在变化,因此目前不同研究者得到的阴茎正常平均值虽然有所增长,但是最小值变化不大,标准差和变异度加大。但是针对DSD 这一特殊人群,由于其性发育身高均未随时代而趋前推进,多数患儿的身高也低于平均值[24],因此小阴茎的诊断值不会变化。故笔者认为在诊断DSD 时,不应过度强调阴茎长度的价值,而应该注重功能的评估。如男孩排尿情况,包括尿线和站立排尿的能力。另外,伴有隐睾或尿道下裂的病理意义更大,单纯小阴茎较少,提示需谨慎做进一步评价。
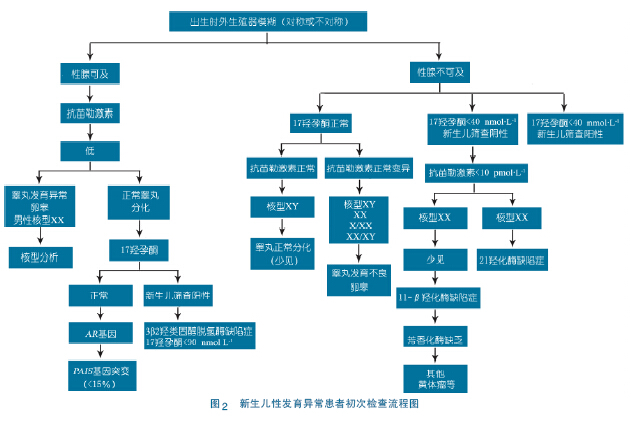
2.4 内分泌评估[25,26] 伴有严重生殖器畸形的新生儿早期进行详细检查十分重要,以避免可能会危及生命的肾上腺危象的发生。首先应进行的检查包括血清17 羟孕酮,抗苗勒激素( AMH) 及染色体核型分析。染色体核型分析是必需的。图2 为DSD 初筛流程,图3 为DSD 诊断鉴别流程。女性在出生时几乎检测不到AMH 水平,所以在获得染色体核型分析结果之前,可以快速获得婴儿性别信息,对于触不到性腺的DSD 婴儿进行AMH 检测是有帮助的。但不是所有机构都能进行AMH 检测。因此临床无条件检测AMH 也可以略去。影像学检查有一定帮助。基础血清睾酮及其前体浓度在出生后1 年中有2 个时期可以检测。出生后36 h 内,由于残存的母源人绝经期促性腺激素( hCG) 的刺激,睾酮水平较高。另外,在出生后15 ~ 90 d,即“小青春期”因HPA 轴的激活使血清中基础促黄体酮素、卵泡刺激素和睾酮水平可以检测。儿童期由于HPA 轴静默,故hCG 激发试验广泛用于评价睾丸间质细胞功能,如原发性睾丸功能减退症,性激素合成异常,生殖器模糊,特发性小阴茎,隐睾,无睾症。目前关于hCG 试验的标准试验方案文献中仍无一致性意见,多分为标准和延长试验。笔者认为一次hCG 试验来判断睾丸间质细胞的好坏不完全恰当,部分患儿确实存在慢反应的现象。
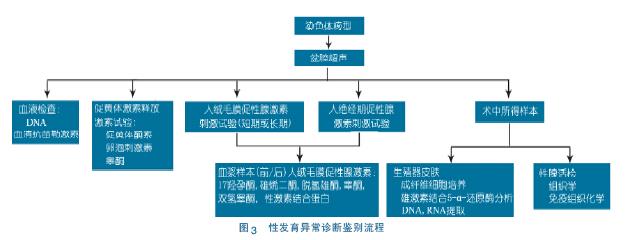
影像学及内镜活检: 超声检查在新生儿期很敏感,因为此时子宫和卵巢在母亲激素的作用下相对较大。CT、MR检查同样可识别苗勒氏管衍生结构,内镜检查则可评估尿生殖窦的情况。当性腺性别不能确定时,可利用腹腔镜检查及组织活检,以确定是否为卵睾、条索状性腺,或发育不良的睾丸,以明确诊断。需要强调的是,腹腔镜检查及组织活检均以诊断为目的,尽量避免同期切除性腺,性腺切除术应该在诊断完全明确以及全面的讨论后进行[27]。
2.5 遗传学评估DSD 的病因诊断对于了解共存何种激素缺乏,对于解决即时的或远期的健康问题有一定的帮助[28]。46,XY DSD 的男孩及男性患者的研究证据表明,其远期发育的结局可能依赖于基因学诊断[29,30]。因此,了解病因不仅有助于向家长及成长中的儿童解释疾病的状态,而且有助于临床医生和患儿及其家庭为患儿的未来做计划。DSD 的患者重要性别决定基因在逐渐增加。自2006年以来,已经确定了很多与综合征DSD 和非综合征DSD 有关的新基因和遗传位点。如TSPY1,GATA4,CBX2,MAMLD1 和MAP3K1 与46,XY DSD 有关,而SOX3 和WNT4突变与SRY 阴性的46,XX DSD 有关。尽管人类性别发育的遗传学基础有了显著的进步,但基因分子水平能够明确诊断的最多占1 /5[31],而且还未常规用于临床DSD 的诊断。46,XY DSD 的遗传背景最为复杂,涉及的基因比46,XX DSD 更多。
3 DSD 患者的管理和治疗
虽然儿科内分泌医师对于DSD 的主要任务在于评估患儿状况,但其间的管理也是非常重要。出生时性别不能确定是令家长极为烦恼的事情,影响到养育的性别。减轻性别异常家庭的耻辱感也是医师需要考虑的[32 ~ 34]。
DSD 患儿管理的第一步是性别判定,根据基因型、表现型、生殖器官的情况、生育力的潜能、文化背景和家庭的信仰等判断。性别判定最初目的是在患者的性别判定和性别认同之间获得最大可能的一致。一旦性别判定,后续可能为手术、激素治疗或根本不用干预。对于已经明确病因和预后的DSD,向患者及其家庭说明既往和当前相关问题医学处理概况,将来可能的发展趋势,在指南的指导下医生与患者及其家庭共同决定医学处理的方法。对于病因不能明确诊断的DSD,预后也是不确定的,争议早治疗还是晚治疗的意义不大。因为DSD 疾病的异质性,个体化的治疗,量身定制的治疗策略是最优化的选择。患有卵睾DSD 的患者和性腺发育不全的患者在重建修复术之前,需要在尽可能充分的评价后,选择保留优势性腺性别,进行劣势性腺切除术,而处于青春期年龄这类患者可能需要激素替代治疗。
手术由患者决定,而不是家长决定,这是更高层次的人性化的考虑。而生殖器重建手术方案应是保护性的而不是清除性的[35,36],是解决性别判定错误造成性别改变的有效方法,这样可以去除争议,而且有些手术并非必要[36],因此保守的处理是更切实际的。上述这些处理原则的形成,来源于经手术矫正过的并对现状不满意的DSD 患者。他们对性满足和性功能降低的现状很不满意[37 ~ 40]。虽然指南给予了处理原则,但是解决不了所有DSD 患者的多样需求,因此以DSD 患者为中心的医患沟通,并达成一致,是最有实际意义的医学处理步骤。
笔者认为临床选择治疗策略的原则是分级进行。
风险分级评估: ①是否危及生命; ②是否影响功能; ③是否影响外观; ④是否可以等待。
治疗分级: ①去除危及生命因素,无论是药物或是手术,应立即进行处理( 如休克或者肿瘤) 。②解决和改善功能,首选性腺生殖能力的保护,次选对非生殖能力功能的影响。③外观修补: 择期进行,首先考虑患儿心理健康的影响因素存在,次要考虑父母羞耻感。④保守原则第一,依据患儿现有的器官组织决定,颠覆性的处理待青春期后和成人期再决定。
DSD 患者的外科重建手术通常基于以下因素进行: ①改善外生殖器外观,②获得无阻碍的具有性别特异的排尿方式( 如男性可以站立排尿) ,③完成阴道阴茎性交。虽然DSD 患者的外科重建手术已经尝试和探索了十多年,目前关于不同的年龄哪种手术最好,何种类型的术式可以获得最好的结果,是否DSD 患者都适合手术治疗目前仍有很大的争论。支持婴儿期即进行手术的学者认为,婴儿期操作比较简单,结果较儿童期手术者更好,且可以减轻生殖器模糊患儿及其家属生活上的耻辱感。支持稍晚些进行重建手术的学者认为: ①手术更适合由患者决定而不是其家长; ②生殖器重建手术方案的选择应以保护原则为先,以防最初的性别判定是错误的和有性别改变的需求; ③有的DSD 患者并没有行生殖器成形术的需求,无需早期手术[36]; ④很多进行过重建术的成人患者对结果十分不满意。
目前指南中DSD 最佳手术时间和手术方案的意见,是在缺乏足够多和好的研究数据下产生的。遗憾的是,手术时间等缺乏循证数据。如指南建议先天性肾上腺皮质增生症( CAH) 的Ⅲ度以下无需手术。如发表于Endocrine Society 上有关21-羟化酶缺乏导致的CAH 患者的临床实践指南中提出如下声明: “建议对于严重男性化的患者,Prader≥3 期的女性患者可以考虑在婴儿期进行阴蒂和会阴修补术”[41],同时也指出,目前无证据提示早期手术或晚期手术可以更好的保护性功能,且目前早期手术存在性别矛盾的问题,这导致患者需要再次手术以更换性别,尤其当患者处于青春期或成年期时。
性别决定必须遵守伦理原则,笔者认为: ①为了患儿及其家长的心理状况健康发展,宜早进行暂时的性别选择,完成外阴的外观修补术; ②性腺尽量保留患儿的最初状态; ③达到不危及生命,可正常生长的目的,直至有能力自己选择性别后进行第二次性别决定。
小阴茎是否宜治疗,治疗以什么为目标。笔者认为: ①为了最大限度地保证治疗安全性,在充分评估阴部外观、性腺和内分泌激素水平后,在与患儿家庭达成一致意见后,对于当下决定男孩养育者,使其能够站立排尿,宜在3 岁前完成手术; ②是否治疗小阴茎以修补尿道下裂能够完成站立排尿为准则; ③以达到能够手术标准为治疗的终级目标,避免过度用药[41,42]。
4 有关肿瘤的潜在性的评估
生理上,DSD 患者除了常伴性腺和外生殖器发育不良外,最主要的是担心是性腺肿瘤的发生。性腺肿瘤在儿童总体少见,以生殖细胞瘤( germ cell tumor,GCT) 为多[43]。
生殖细胞不同于一般的体细胞,体细胞在生后已经基本分化成熟,而生殖细胞仅仅完成了初步分化,在青春期后,随着性腺的发育,生殖细胞逐步分化成熟[44]。如初生后的正常女婴卵巢是初级卵母细胞,而男婴随睾丸的不断发育,在曲细精管分化以后,精原细胞在青春期后才逐渐产生各级精母细胞( 初级精母细胞、次级精母细胞、精子细胞) 。
对肿瘤的担心源于某些研究: GCT Ⅱ型在DSD 患儿中的发生率较一般人群增加,是20 ~ 40 岁男性最常见的睾丸肿瘤。所有GCT Ⅱ型都起源于原始生殖细胞( primordial germ cell,PGC) ,该细胞在性分化的第一阶段形成。DSD患者的性发育受阻于该阶段,这种病理过程在宫内发育时就埋下“种子”,在生发之初由于自身原因不能将分化进行下去,即发生所谓“停滞”[45]。停滞的PGC 有两种结局: 或被诱导凋亡,或是自身“瘤化”( embryonic,胚胎化) 而逃避凋亡[46,47]。“瘤化”细胞这一阶段,相当于在病理学上的“癌前病变”。表面上看,和众多成人肿瘤的“癌前病变”所描述的似乎是一回事,实则不然。所谓未分化的“种子”,实际是形态学的描述,是病理上细胞形态学的描述性称谓,人类生殖细胞自身具有生后二次分化的特点,在儿童性腺中发现的所谓“癌前病变”,在性腺发育障碍患儿中的发生发展,与成人肿瘤形成有着鲜明的差异,且在性腺发育不良基础上的肿瘤发生,与人类遗传基因的缺陷之间的对应关系,更容易寻找到因果关联,或是根据潜在因素作出更为准确的发生风险评估。
生殖细胞的癌前病变,别名有多种称谓: 曲细精管内恶性生殖细胞、曲细精管内浸润前肿瘤、曲细精管内不典型生殖细胞、原位癌、原位生殖细胞肿瘤、睾丸上皮内肿瘤[48]。
WHO 人类肿瘤组织学及遗传学分类中将其统称为小管生殖细胞肿瘤未定类型( intratubular germ cell neoplasia,unclassified type,IGCNU) [49]。隐睾儿童IGCNU 占0.5%~5%[50,51]。由于在病理上,青春期前的正常生殖细胞形态和免疫组化特点与IGCNU 相似,所以青春期前的IGCNU发生率很难评估[52,53]。因此青春期前IGCNU 的诊断应该继续研究。
无论DSD 患者涉及的是男性还是女性生殖细胞,都有共同的性腺分化异常的细胞学特点。IGCNU 癌变的风险显然影响异常发育性腺的手术切除时机的决策。但是支持早期切除性腺的往往既不是Turner 综合征患者( 常表现为条索性腺) ,也不是隐睾患者,而是罹患某些特殊疾病的患儿,如永存苗氏管综合征( PMDS) 、满足一定条件的45X/46XY 嵌合体等具有特殊病因者,这系列疾病的共性是在HPG 轴相对静默的儿童期,发育不良的性腺发生恶变。近年此类不同疾病发生肿瘤的报道见表4 ~ 7。青春期建议尽早切除或行性腺活检术的危险列表则包括未经早期手术处理的隐睾症、雄激素不敏感综合征( androgen insensitive syndrome,AIS) 。
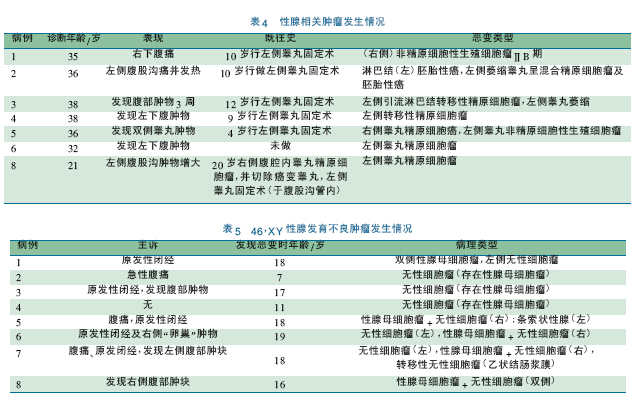
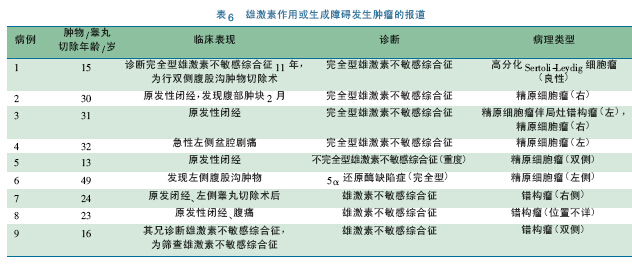
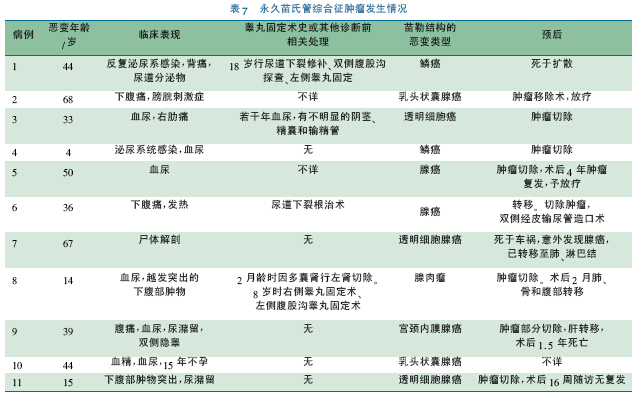
从表4 ~ 7 可以发现以下特点: ①恶性肿瘤发生年龄均较大: a.PMDS 成年期发生肿瘤,均有泌尿系统症状,最多见的为血尿、尿潴留和尿路刺激征; b.隐睾伴肿瘤者,青春期后发病者,行睾丸固定术年龄> 1 岁,在腹股沟内的肿物恶变时患者年龄早到成年早期( 21 岁) ; 青春期前或之中的发病者,以癌前病变多见。c.AIS,5α 还原酶缺陷症: 发病年龄均在青春期及之后,且多为原发性闭经( 而非双侧腹股沟疝) 初次就诊,恶变类型均为精原细胞瘤。②年龄小者发生的肿瘤多无症状,做性腺活检或者切除术后病理报告而发现,此类肿瘤很难与正常分化的儿童性腺细胞区分,意义实则不明[54]。
就隐睾而言,为了更好地睾丸发育,隐性睾丸患儿主张尽早固定,而不是防治癌症。目前推荐在6 ~ 12 月龄行固定术,从而为生后睾丸早期发育创造条件[55 ~ 62]。研究发现,隐睾儿童中期开始有睾丸萎缩,1~ 2 岁有电镜下改变,2 ~ 3 岁后会有组织学变化。近来发现生殖母细胞3 ~ 6 月龄时就不能转化为成人的暗精原细胞。因此隐睾手术的年龄一降再降。尽管对隐睾采用固定术的时间提早了,但长期结局一直争论不休。以生殖能力结局的研究报道认为:单侧隐睾33%受损,双侧隐睾66%受损。以成年期患癌症结局研究报道认为: 隐睾患者高出正常人的10 倍[63]。
总之,不同的DSD 肿瘤风险不同。但青春期前恶变不常见。采用2006 年美国和欧洲儿科内分泌学会的DSD 肿瘤风险评估标准,进行高危、中危、低危和风险不明的4 级的评估,有助于制定治疗策略[64]。







