性别并不象人们想象的那样简单,在形形色色的性别问题背后隐藏许多并未让人所知的奥秘,它涵盖了遗传、生理、社会和心理等方面的内容。性别决定和性发育是个体正常生长和发育过程的重要环节,在这一过程中,多重因素按照一定的规律共同作用,最终决定个体性别;而在决定性发育的任何一个层次出现差异,均会导致性别异常。本文将从性别决定和性发育过程阐述先天性肾上腺增生症的临床特征和发生机制。
1 性别决定与性发育
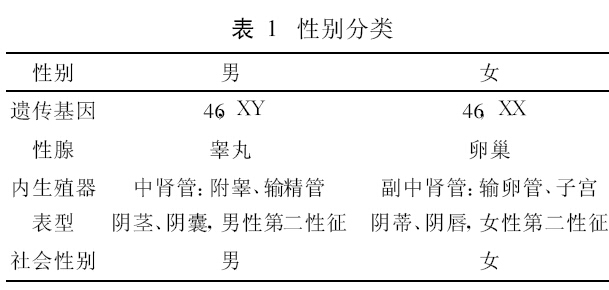
性别可以分为社会性别、表型性别、内分泌性别、性腺性别和染色体性别(表1)。正常人在以上五个性别层次上,保持完全一致。一旦胚胎期,任何一个层次上性别出现差异,即表现为性发育异常。性发育有两个法则,一是染色体决定性腺发育;二是内分泌,或者说激素决定生殖器发育。长久以来,人们知道,Y染色体有一种或一组基因决定睾丸分化,称为睾丸决定因子。1990 年Sinclair等[ 1] 从46,XX女性性反转患者,克隆了SRY基因。SRY基因只有一个外显子,编码204个氨基酸,24ku大小,具有转录因子活性,DNA结合域序列为A/TAACAAT/A。SRY基因突变导致46,XY男性性反转。原始性腺始基只有一个,46,XY核型,由于携带有SRY基因,性腺分化为睾丸;而46,XX核型,由于缺少SRY基因,性腺分化为卵巢。
外生殖器始基只有一套,在雄激素作用下分化为阴茎、阴囊,在缺乏雄激素的作用下,分化为阴蒂、大小阴唇。睾酮与双氢睾酮的作用有所差别。雄激素和AMH决定内生殖器分化,双氢睾酮在外生殖器分化中起重要作用。雌激素在性腺分化的作用并不重要,但在青春期女性外阴发育和第二性征发育上起重要作用。
2 性发育异常
性发育异常包括染色体异常,如45,X0的特纳(Turner)综合征、47,XXY的克氏(Klinefelter)综合征等和性激素异常。由于雄激素在外生殖器的发育上起重要作用,因此任何导致雄激素合成、分泌和作用缺陷的因素,均引起性发育异常。雄激素产生异常主要包括先天性肾上腺增生,其中的原因有21羟化酶缺陷症、17 -羟化酶缺陷症、11 -羟化酶缺陷症、3-羟类固醇脱氢酶缺陷症、类脂性肾病。雄激素产生异常还包括17 -羟类固醇脱氢酶缺陷、黄体生成素(LH)受体缺陷、5-还原酶缺陷症、芳香化酶缺陷症。激素不敏感综合征系雄激素受体缺陷导致的雄激素抵抗所致,分为完全型和部分型(又称Reifenstein综合征)。鉴于性别异常的分子遗传学病因研究的进展以及伦理和维权的需要,许多术语,如“阴阳人”、“假两性畸形”、“性反转”等可能对患者带来偏见,使医务工作者和家属引起费解,已被新的术语“性发育异常”(disordersofsexdevelopment,DSD)所取代[ 2] 。染色体异常包括Klinefelter综合征、Turner综合征、45,X0/46,XY性腺发育不全,46,XX/46,XY性腺发育不全,其余性发育异常分类见表2。
3 先天性肾上腺增生症与性发育异常
先天性肾上腺增生症(Congenitaladrenalhyperplasia,CAH)是一组由编码皮质激素合成途径的必需酶基因突变致肾上腺皮质类固醇激素合成障碍所引起的疾病,呈常染色体隐性遗传,为引起两性畸形最常见的病因。由于酶的缺陷引起皮质醇合成不足,继发下丘脑促生长激素释放激素(CRH)和垂体促肾上腺皮质激素(ACTH)代偿性分泌增加,导致肾上腺皮质增生。同时伴有雄激素合成的显著增加或减少,引起性发育异常。主要涉及肾上腺皮质激素合成缺陷的酶包括20,22碳裂链酶、类固醇激素合成急性调节蛋白(StAR)、17α-羟化酶(CYP17)、3β 羟类固醇脱氢酶(3β -HSD)、21-羟化酶(CYP21)、11β-羟化酶(CYP11B)。
临床上,以21 羟化酶缺陷症最为常见,其次为11β 羟化酶缺陷症和17羟化酶缺陷症,其他类型较为少见。
3.1 21羟化酶缺陷症 21羟化酶缺陷症(21OHD)是先天性肾上腺增生症的最常见类型,占90%以上。21羟化酶作用是使孕酮和17-羟孕酮转变为去氧皮质酮和去氧皮质醇。当编码21羟化酶的基因缺陷时,引起21羟化酶的活性下降,肾上腺糖皮质激素和(或)盐皮质激素合成受损,致ACTH代偿性升高,引起双侧肾上腺的增生;其前体物质孕酮和17-羟孕酮增多,进一步分别转变为脱氢表雄酮和雄烯二酮,雄烯二酮再进一步转变为睾酮,导致雄激素合成过多,表现为女性假两性畸形和男性性早熟。临床上,根据疾病的严重程度,分为经典型,包括失盐型和单纯男性化型以及非经典型等连续的疾病谱。失盐型存在醛固酮和皮质醇的合成不足,除出现外生殖器的畸形外,出生早期即出现电解质紊乱;而单纯男性化型主要以过多的雄激素合成为主,导致出现女性男性化和男性性早熟;非经典型往往症状不典型,主要表现为多毛、痤疮等高雄激素血症的表现。另外,21OHD的临床表现,往往与酶活性改变程度有关。研究提示,21-羟化酶缺陷症基因分型和临床表型高度吻合(90%),不同的基因型分别与不同的表型相对应[ 3] 。因而,基因突变的筛查能够有助于21OHD的鉴别诊断和临床分型。

除临床表现外,21OHD的诊断很大程度上依赖于17羟孕酮(17OHP)的水平。21OHD最重要的生化异常即21羟化酶的主要底物17OHP的显著升高。仅凭一次随机血17OHP超过242 nmol/L足可以诊断。但在新生儿筛查中早产儿常可出现假阳性结果,因此需要建立体重和妊娠周数的正常值范围。对于非典型的21OHD,临床症状不典型且17OHP可正常,ACTH兴奋试验成为公认标准。ACTH 250 μg静推后60 min取血测17OHP水平,如超过45 nmol/L以上则可诊断。对于ACTH兴奋试验后60 min的17羟孕酮浓度在30~45 nmol/L患者,基因型的检测显得尤为重要。而基础以及ACTH激发后17OHP水平在正常人群、基因突变携带者、非典型、典型人群中逐渐升高,呈非常好的正相关[ 4] 。
非经典型21OHD患者睾酮和雄烯二酮的水平也有所升高,但低于经典型,目前认为脱氢表雄酮比前两者更有诊断意义。经典型21OHD结合临床表现及激素水平,诊断上往往并不困难;而非经典型21OHD症状隐匿,临床上有相当一部分非经典型21OHD患者被误诊或漏诊。非经典型21OHD在不同人群中所报道的发生率存在很大的差异(0.1%~1.0%),而在高雄激素血症的妇女中可达1%~10%。同时,由此而引起的慢性高雄激素血症与胰岛素抵抗及其他代谢紊乱的发生关系密切,危害极大[ 5] 。因此非经典型21OHD的诊治应当引起足够的重视。其临床表现缺乏特异性,往往仅有轻度雄激素过多症状和体征,常混杂于高雄激素血症的其他病因中,与多囊卵巢综合征(PCOS)的临床特征相近,可以因为任何年龄段出现一定的临床表现而引起注意,也可长期无任何临床症状。患者出生时外生殖器正常,往往在出生后因有轻度雄激素过多症状和体征而被诊断[ 6] ,基因型多为外显子突变和启动子区变异形成的复合杂合变异[ 7-8] 。
3.2 11β 羟化酶缺陷症 11β 羟化酶缺陷症(11βOHD)为CAH中的较少见类型,一般约占所有CAH病例的5%~8%。当11β -羟化酶缺陷时,11-去氧皮质酮(DOC)和11-去氧皮质醇不能被进一步转化成皮质酮和皮质醇,皮质醇的合成减少,促肾上腺皮质激素(ACTH)分泌增加刺激肾上腺皮质的束状带增生,产生过量的皮质酮和皮质醇的前体物质。这些前体物质中的一部分通过17α-羟化酶/17,20裂链酶转而进入肾上腺性激素合成途径。11β OHD患者因酶缺陷所致前体物质脱氧皮质酮(DOC)及硫酸脱氢表雄酮(DHEAS)大量堆积,DOC兼有较强的理糖和理盐作用,临床上会出现肾上腺增生伴有低肾素性高血压、低血钾;而过多的DHEAS令男性患者出现性早熟,女性患者表现为女性假两性畸形,与21OHD相似,但程度往往较轻。
3.3 17羟化酶缺陷症 17羟化酶缺陷症(17OHD)是先天性肾上腺增生中较为少见的类型。17 -羟化酶催化孕烯醇酮转变为17羟孕烯醇酮和孕酮转变为17 羟孕酮,同时还有17,20碳链裂解酶活性,将17羟孕酮转变为脱氢表雄酮和17羟孕酮转变为雄烯二酮。一旦17羟化酶缺陷,前体物质孕烯醇酮和孕酮增加,进一步转变为去氧皮质酮、皮质酮和醛固酮,引起低肾素性高血压和低血钾。由于17羟孕酮减少,去氧皮质醇和皮质醇合成减少,对垂体ACTH负反馈解除,ACTH大量分泌,促使肾上腺皮质增生。由于雄烯二酮减少,睾酮合成减少,在男性表现为男性女性化(男性假两性畸形);在女性表现为性幼稚。我们收治了11例17OHD患者,10 例表现为原发性闭经,1例有规律月经。年龄平均21岁,身高167 cm,血压146/101 mmHg。外生殖器均为幼稚女性。实验室检查:染色体核型7例46,XX、4例46,XY;骨龄平均12 岁;血钾3.08 mmol/L,雌二醇(E2)49.0 pmol/L,卵泡刺激素(FSH)55.6 U/L,黄体生成素(LH) 22.2 U/L,皮质醇66.2 nmol/L,ACTH141.8 pmol/L。均发现CYP17A1基因突变,其中5 种突变类型为国际上首先报道[9] 。其中1例有规律月经的患者,仅表现为轻度高血压和低血钾。进一步基因检测发现,其CYP17A1基因为F453S位点纯合错义突变(1418T>C),体外功能研究发现,17羟化酶活性保留约30%[ 9] 。
总之,Y染色体上的SRY基因决定性腺发育,雄激素决定外生殖器发育。21OHD和11OHD患者由于大量雄激素产生,主要表现为46,XX性发育异常(或女性假两性畸形),以及男性性早熟;非典型21OHD患者临床症状较轻,表现似PCOS,应当注意鉴别。17OHD患者由于雄激素缺乏,主要表现为46,XY性发育异常(或男性假两性畸形),以及由于雌激素同时缺乏表现为女性性幼稚。17 羟化酶活性部分缺乏的17OHD患者,可以表现为不典型的高血压、低血钾和性幼稚,与基因突变类型密切相关。
参考文献
[1] SinclairAH,BertaP,PalmerMS,etal.A genefrom thehuman sex-determiningregionencodesaproteinwithhomologytoaconservedDNA-bindingmotif[ J] .Nature,1990,346:240 -244.
[2] LeePA,HoukCP,S.Ahmed,F etal.ConsensusStatementon ManagementofIntersexDisorders[ J] .Pediatric,2006,118:488 -
500.
[3] MerkeDP,BornsteinSR.Congenitaladrenalhyperplasia[ J] .Lancet,2005,365(9477):2125 -2136.
[4] NimkarnS,Lin-SuK,NewMI.Steroid21-HydroxylaseDeficiency CongenitalAdrenalHyperplasia[ J] .EndocrinolMetab ClinN Am,2009,38(4):699 -718.
[5] ZhangHJ,YangJ,ZhangMN etal.Metabolicdisordersinnewly diagnosedyoungadultfemalepatientswithsimplevirilizing21-hydroxylasedeficiency[ J] .Endocrine,2010,38(2):260 -265.
[ 6] 张惠杰,杨军,李小英.非经典型21羟化酶缺陷症的研究进展[ J] .国际内分泌代谢杂志,2007,27:418 -421.
[ 7] 张惠杰,杨军,顾生虹,等.新复合杂合突变致非经典型21 羟化酶缺陷症[ J] .中华内分泌代谢杂志,2007,23:396 -399.
[8] ZhangHJ,YangJ,ZhangMNetal.Variationsinthepromoterof CYP21A2 geneidentifiedinaChinesepatientwithsimplevirilizing form of21-hydroxylase deficiency[ J] .Clin Endocrinol(Oxf),2009,70(2):201 -207.
[9] YangJ,CuiB,SunSetal.Phenotype-genotypecorrelationineight Chinese 17 alpha-hydroxylase/17,20 lyase-deficiencypatients withfivenovelmutationsofCYP17A1 gene[ J] .JClinEndocrinolMetab,2006,91(9):3619 -3625.







